2种细菌降解蒙东褐煤产腐植酸的研究
时间:2024-05-27 来源:中国煤炭杂志官网 分享:★ 清洁利用——北京国华科技集团有限公司协办 ★
2种细菌降解蒙东褐煤产腐植酸的研究
0 引言
煤炭作为我国最重要的基础性能源之一,同时也是化工生产过程中的重要原料,其储量一直稳居我国化石能源之首。我国低阶煤资源中的褐煤、风化煤和泥炭等占比较高,低阶煤因其水分高、挥发分高以及燃烧热值低等缺点被视为劣质燃料,而且其含有的硫、氮、磷等有机质元素在燃烧后会形成污染源对环境造成较为严重的破坏,因此低阶煤的清洁高效利用是低阶煤可持续发展的必由之路。内蒙古地区作为我国重要的煤炭基地,2022年,该地区规模以上原煤产量达11.74亿t,约占全国煤炭总产量的26.1%[1],且以褐煤、长焰煤、不黏煤等低阶煤为主,其中褐煤占比较高,因此对该地区褐煤资源的清洁化利用具有重要意义。
矿物源腐植酸作为重要的生物质,普遍存在于褐煤等低阶煤资源中,在较多领域都有着广阔的用途。腐植酸(HA)是一种天然的大分子物质,主要是由动植物遗骸经过微生物分解、降解和一系列的地球地理化学反应形成的,腐植酸结构中含有丰富的羧基、酚羟基、羰基、磺酸基和甲氧基等活性含氧官能团,这使得腐植酸具有酸性、离子交换性、胶体性能及络合性能等重要的物理化学特性,因此腐植酸被广泛应用于农业、医药以及环保等领域[2-5]。在褐煤、风化煤和泥炭中都含有丰富的矿物源腐植酸,从煤中提取腐植酸方法较多,主要包括酸抽提法、碱抽提法及微生物溶解法[5]。酸抽提法和碱抽提法因操作简单、产率较高最为常用,但是这2种方法存在需使用大量化学试剂、成本高、污染环境等缺点[6-8],微生物降解法是20世纪初开始研究的一种新的煤炭降解方法,通过微生物溶解法提取腐植酸,具有反应条件温和、清洁无污染、产品生物活性高等优点,但也存在腐植酸产率相对较低的缺点[9-14]。
目前,微生物降解低阶煤的研究虽然取得了一定的成果,但是仍然需要在筛选高效广谱性的降解菌株、提高降解率、洞悉降解机理以及降解产物的分离和高效利用等方面加大研究力度。SHI C等[15]等研究表明,组合表面活性剂的引入可以极大地提高茫崖诺卡氏菌对新疆五彩湾煤的降解率,并进一步研究了表面活性剂对细菌降解低阶煤的作用机理;YANG L等[16]通过优化复合微生物菌群来提升褐煤的产甲烷率;NIU Y等[17]使用蛋白质组学分析褐煤生物降解过程中的Fusarium sp. NF01,深入研究了Fusarium sp.在降解褐煤过程中的响应机制;SAVY Davide等[18]研究了生物质与壳聚糖制成的新型纳米材料的抗菌性能。近些年随着研究人员对微生物降解低阶煤的机理及其产物降解方面的研究[19-20],低阶煤的微生物降解得到了相关研究专家的关注,其清洁、无污染的特点也符合我国“双碳”目标的相关政策。
本文利用单因素和正交实验确定了假单胞菌属和粪产碱杆菌降解蒙东褐煤提取生物腐植酸的最佳降解条件,并通过UV-vis、FTIR、XPS及营养元素检测的表征方法对微生物提取的腐植酸(bHA)、碱抽提法所得的腐植酸(cHA)进行对比分析,以此来探究生物腐植酸的产率和性质,为微生物降解褐煤产腐植酸并在农业生产领域的应用提供依据。
1 实验研究
1.1 煤样的制备
实验所用煤样为蒙东褐煤,先利用球磨机将其破碎并进行筛分,获得粒径为0.125~0.250 mm的样品,再用10 mol/L的硝酸对原煤氧化48 h,并用去离子水洗涤至中性,烘干、灭菌后备用。
根据《煤的工业分析方法》(GB/T212-2008)和《煤的元素分析》(GB/T31391-2015)的方法,利用Perkin Elmer 2400分析仪和5E-S 3200库仑硫分析仪对硝酸氧化前后的煤样进行工业分析和元素分析,氧化前后煤样的工业分析和元素分析见表1。
表1 氧化前后煤样的工业分析和元素分析 %
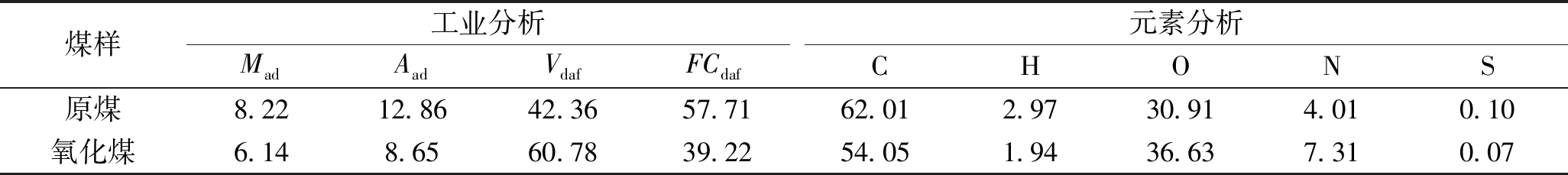
煤样工业分析MadAadVdafFCdaf元素分析CHONS原煤8.2212.8642.3657.7162.012.9730.914.010.10氧化煤6.148.6560.7839.2254.051.9436.637.310.07
由表1可知,原煤经硝酸氧化后C、H、S含量降低,O、N含量增加,灰分变化不大,挥发分升高,这是由于硝酸与煤样反应,使芳香环羧基化,侧链烷基氧化和硝化[15]。
1.2 菌种的培养
由于煤的形成过程与石油类似,所以本研究选取能降解原油的假单胞菌属(Pseudomonas sp.);另外,在褐煤等低阶煤中含有脂肪烃等烃基单元,所以又选择具有脂肪酶活性的粪产碱杆菌(Alcaligenes faecalis)[21],2种菌均购买于中国微生物菌种保藏中心(CICC),编号分别为CICC 22131和CICC 21904。培养基均采用CICC所提供的牛肉膏培养基配方,即牛肉膏3 g、蛋白胨5 g、氯化钠5 g、去离子水1 L。将菌种接种于装有50 mL牛肉膏培养基的锥形瓶内,并置于恒温30 ℃、转速160 r/min的摇床内振动培养。
1.3 生物腐植酸的提取
1.3.1 单因素实验设计
在含0.3 g灭菌煤样的150 mL锥形瓶中加入50 mL灭菌的牛肉膏培养基和10 mL菌液,置于恒温30 ℃、160 r/min的振动培养箱内提取18 d。分别改变煤浆浓度(0.1~1.0 g/50 mL)、提取时间(2、4、6、8、10、12、14、16、18 d)、菌液用量(2、4、6、8、10、12、14、16、18 mL/50 mL)研究各因素对生物腐植酸产率的影响,实验结束离心(1万 r/min,20 min)后分离固相产物和液相产物备用。
1.3.2 正交实验设计
在单因素实验的基础上,设计三因素三水平正交实验得出假单胞菌属和粪产碱杆菌降解蒙东褐煤提取腐植酸的最佳工艺条件,2种细菌降解氧化煤提取腐植酸的因素及水平见表2。
表2 2种细菌降解氧化煤提取腐植酸的因素及水平

水平假单胞菌属A-煤浆浓度/(g·(50 mL)-1)B-降解时间/dC-菌液用量/(mL·(50 mL)-1)粪产碱杆菌A-煤浆浓度/(g·(50 mL)-1)B-降解时间/dC-菌液用量/(mL·(50 mL)-1)10.41020.510220.51240.612430.61460.7146
1.3.3 生物腐植酸产率的计算
生物腐植产率的计算见式(1)[6]:
(1)
式中:ε——腐植酸产率,%;
m1——起始煤样的质量,g;
Mad——起始煤样的含水量,%;
m2——残煤的质量,g。
将离心后所得固相产物用蒸馏水洗涤至无菌体残留,干燥称重,通过式(1)计算腐植酸产率。
1.3.4 生物腐植酸和化学腐植酸的提取方法
(1)生物腐植酸提取。将离心后的液相产物用0.22 μm的微膜过滤器进行过滤获得滤液,用6 mol/L的HCl酸化至pH<2的沉淀腐植酸,并通过离心(4 000 rpm,30 min)进一步分离腐植酸,然后再利用Spectrapore膜(MWCO 3500)纯化和透析腐植酸,直到游离氯离子被洗掉,最后冷冻干燥,获得2种生物腐植酸(bHA)。其中,bHA(1)为假单胞菌降解蒙东褐煤所提取的生物腐植酸,bHA(2)为粪产碱杆菌降解蒙东褐煤所提取的生物腐植酸。
(2)化学腐植酸提取。用0.1 mol/L的 NaOH和0.1 mol/L 的焦磷酸盐溶液从氧化煤中抽提,比例为1∶10(煤样/g∶萃取剂/mL),然后再通过上述步骤提取获得化学腐植酸(cHA)[17]。
1.4 煤样及腐植酸的表征
采用Perkin Elmer 2400分析仪和5E-S 3200库仑硫分析仪器对原煤及硝酸氧化后的煤样进行元素分析;使用TU1950 型紫外可见分光光度计(UV-vis)测定腐植酸样品的紫外可见光光谱(扫描波长范围为400 ~700 nm);通过Nicoleti N10 &iZ10型傅里叶红外光谱仪,通过定量溴化钾压片法(固相产物∶KBr=1 mg∶200 mg),在4 000~400 cm-1范围内,分辨率4 cm-1,对腐植酸样品进行红外吸收光谱扫描;利用日本Shimadzu/Krayos AXIS Ultra DLD型号的X- 射线光电子能谱仪对腐植酸样品表面元素进行测试分析;使用KDN-520型凯氏定氮仪和美国Aglient 7800(MS)仪通过凯氏定氮法和ICP法对腐植酸的N、P、K、Ca、Mg元素进行测定。
2 实验结果与分析
2.1 单因素实验结果
单因素对生物腐植酸产率的影响如图1所示。
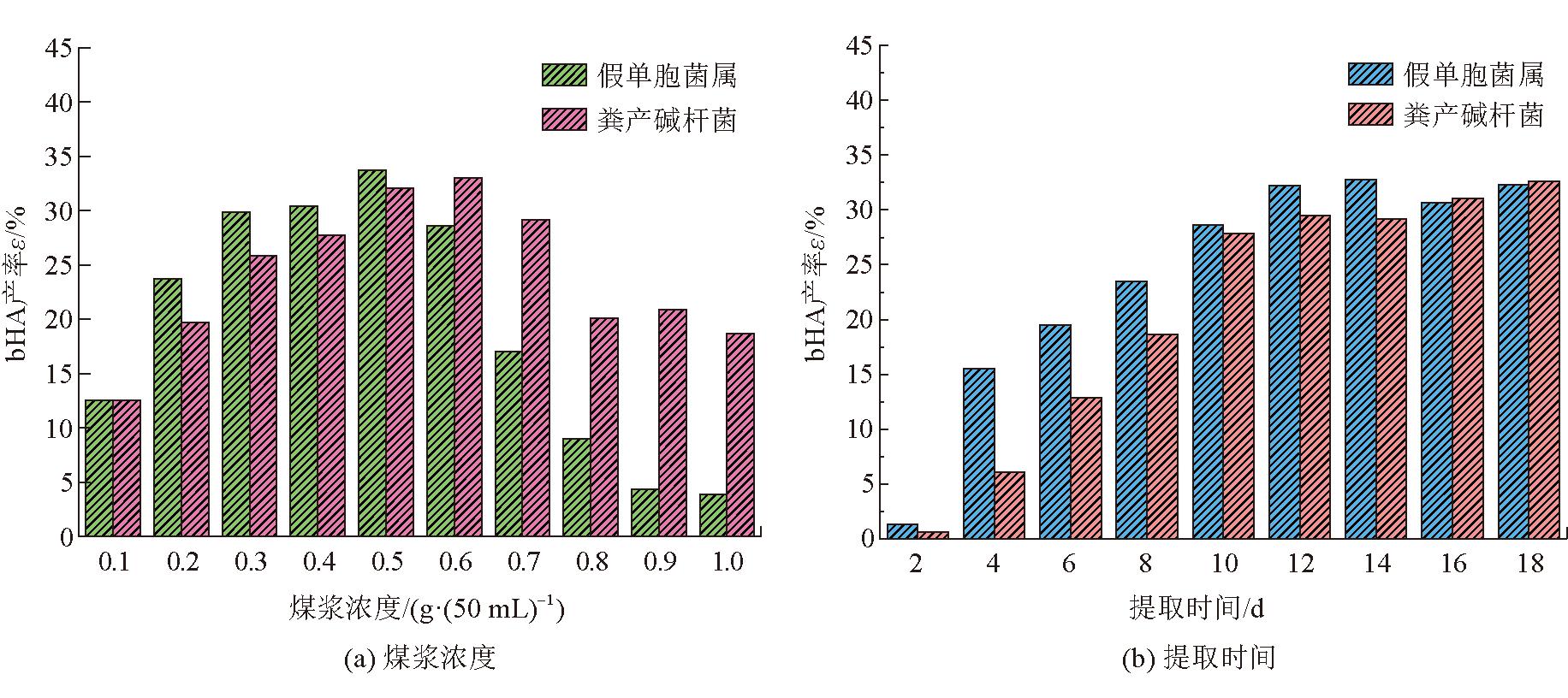
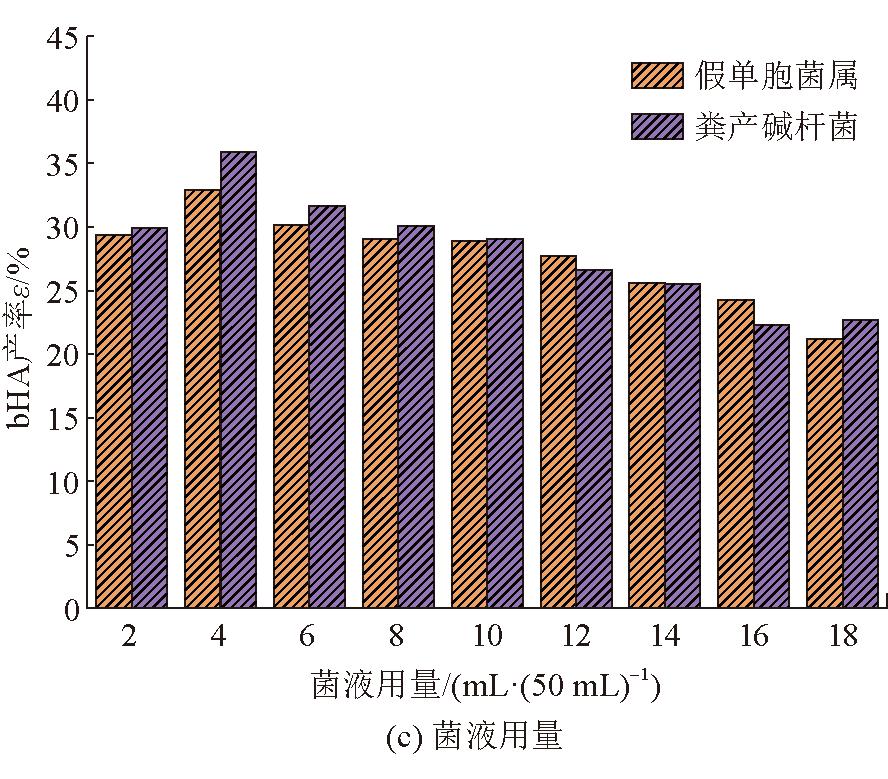
图1 单因素对生物腐植酸产率的影响
由图1(a)可以看出,随着煤浆浓度的增加,假单胞菌属和粪产碱杆菌对于煤样中腐植酸的产率均呈现先增加后降低的趋势。在煤浆浓度分别为 0.5 g/50 mL和0.6 g/50 mL时,达到最优产率分别为33.69%和33.03%,当煤浆浓度过大时则抑制了假单胞菌属和粪产碱杆菌的生长。
由图1(b)可以看出,随着降解天数的增加,假单胞菌属和粪产碱杆菌对煤样中腐植酸的产率均呈现出先增加后趋于稳定的趋势,均在提取12 d时处于缓慢增长期,产率分别为32.2%和29.5%。这可能是在降解时间达到12 d时,培养基中的营养物质几乎被细菌消耗完,部分细菌趋于死亡[22],使12 d后的生物腐植酸产率变化不大。
由图1(c)可以看出,随着菌液用量的增加,假单胞菌属和粪产碱杆菌对煤样中腐植酸的产率大致上呈现出先增加后降低的趋势,2种细菌均在菌液用量为4 mL/50 mL时对煤样中腐植酸的产率达到最大,分别为32.91%和35.86%。这可能是由于菌液接种量较高时,初始菌落基数较大,对营养物质的需求量激增。随着菌液接种量的增加,培养基中的营养物质被快速消耗,当接种量超过一定数值后,有限的营养物质导致了细菌之间的竞争和抑制,从而影响了对生物腐植酸的提取效果。
2.2 正交实验结果
假单胞菌属提取蒙东褐煤腐植酸的正交实验见表3。
表3 假单胞菌属降解氧化煤提取腐植酸正交实验
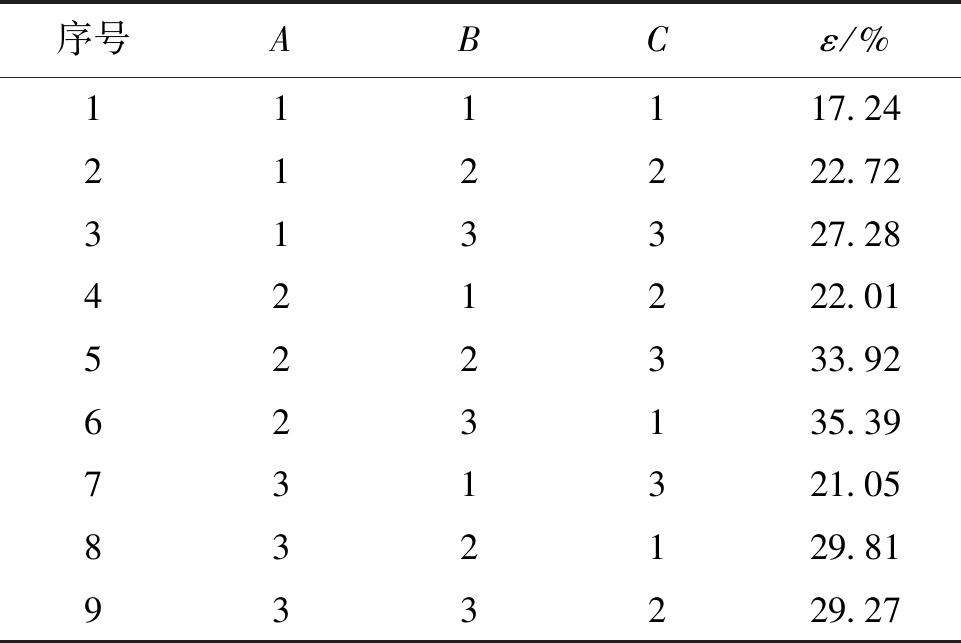
序号ABCε/%111117.24212222.72313327.28421222.01522333.92623135.39731321.05832129.81933229.27
假单胞菌属降解蒙东褐煤氧化煤提取腐植酸的极差分析见表4。
表4 假单胞菌属降解氧化煤提取腐植酸的极差分析
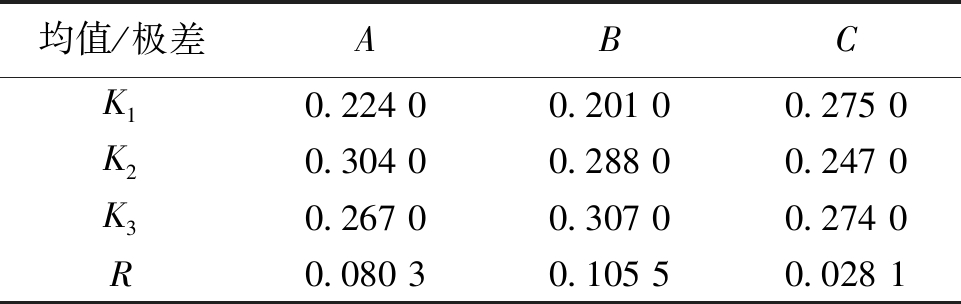
注:K1、K2、K3分别是1、2、3水平条件下9次假单胞菌属降解蒙东褐煤氧化煤产腐植酸的产率之和的均值。
均值/极差ABCK10.224 00.201 00.275 0K20.304 00.288 00.247 0K30.267 00.307 00.274 0R0.080 30.105 50.028 1
粪产碱杆菌属提取蒙东褐煤腐植酸的正交实验见表5。
表5 粪产碱杆菌降解氧化煤提取腐植酸正交实验
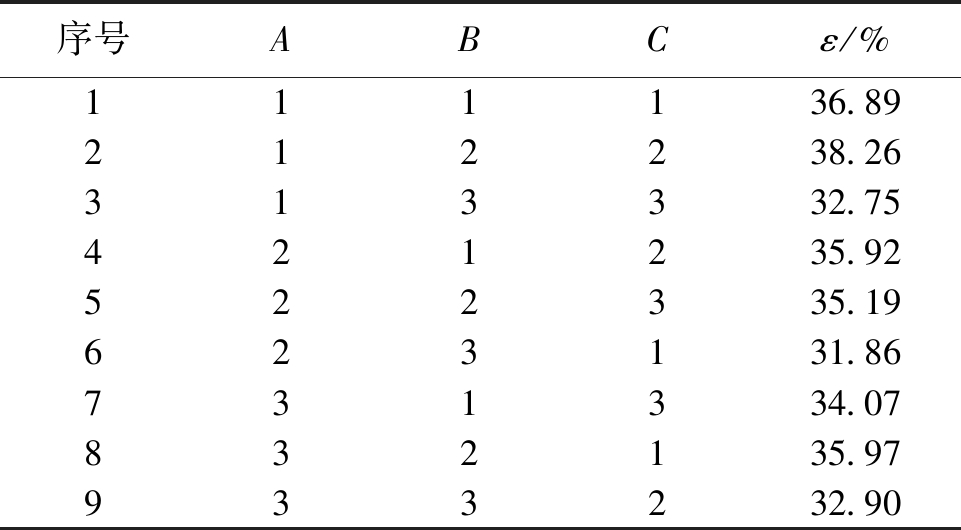
序号ABCε/%111136.89212238.26313332.75421235.92522335.19623131.86731334.07832135.97933232.90
粪产碱杆菌降解蒙东褐煤氧化煤提取腐植酸的极差分析见表6。
表6 粪产碱杆菌降解氧化煤提取腐植酸的极差分析
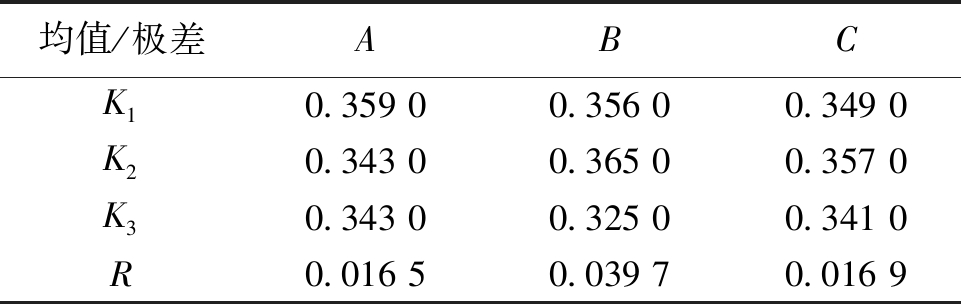
注:K1、K2、K3分别是1、2、3水平条件下9次粪产碱杆菌降解蒙东褐煤氧化煤产腐植酸的产率之和的均值。
均值/极差ABCK10.359 00.356 00.349 0K20.343 00.365 00.357 0K30.343 00.325 00.341 0R0.016 50.039 70.016 9
对表4和表6中的数据进行分析可以得出,根据各因素的K1、K2和K3值得到假单胞菌属的最优工艺组合为A2B3C3,即煤浆浓度为0.5 g/50 mL、提取时间14 d、菌液用量2 mL/50 mL时对生物腐植酸的产率最高,为35.39%;粪产碱杆菌在最优工艺组合为A1B2C2,即煤浆浓度为0.5 g/50 mL、提取时间12 d、菌液用量4 mL/50 mL时对生物腐植酸产率最高,为38.26%。根据正交实验的极差R可以看出,3个因素对假单胞菌属和粪产碱杆菌提取腐植酸的影响由大到小分别为降解时间>煤浆浓度>菌液用量和降解时间>菌液用量>煤浆浓度。
2.3 腐植酸的表征结果
2.3.1 紫外分析
在可见光区域(400~700 nm),腐植酸溶液的吸收光谱从高频到低频呈单调递减趋势,3种矿源腐植酸的紫外可见光光谱如图2所示,其对应的UV-vis图谱参数见表7。
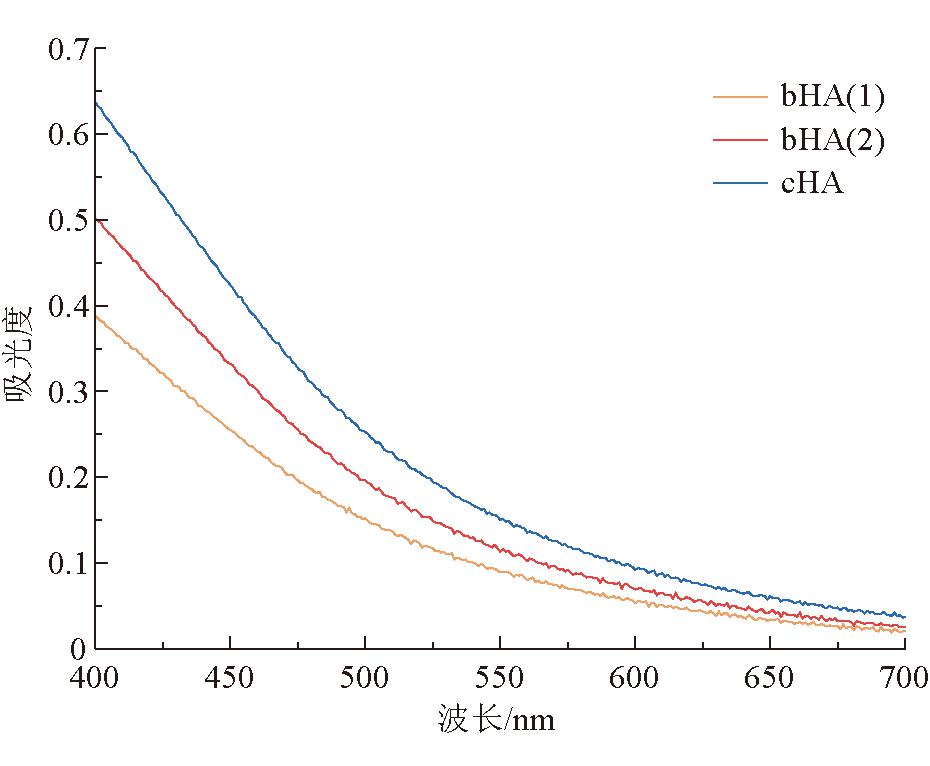
图2 3种矿源腐植酸的紫外可见光光谱
表7 腐植酸样品的UV-vis图谱参数
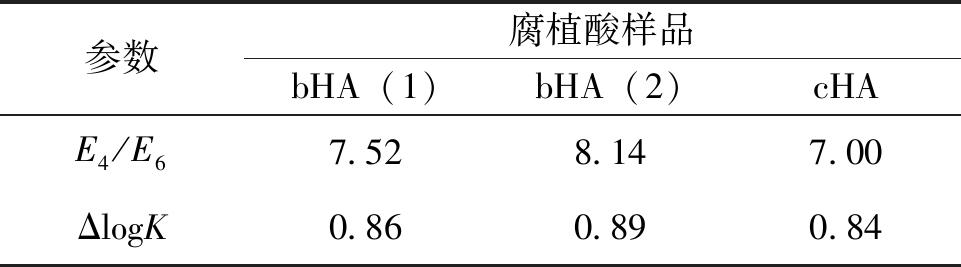
参数腐植酸样品bHA(1)bHA(2)cHAE4/E67.528.147.00ΔlogK0.860.890.84
根据文献可知UV-vis可以用来分析腐植酸的E4/E6值和ΔlogK [23],这2个参数可以用来表征腐植酸分子量,参数越大说明腐植酸的分子量越小,参数越小腐植酸分子量越大。由表7可知,3种腐植酸的E4/E6和ΔlogK值大小为bHA(2)> bHA(1)>cHA,则这3种腐植酸的分子量大小为cHA>bHA(1)>bHA(2),因此表明2种生物腐植酸的分子量低于化学腐植酸。此外,根据ΔlogK值的大小可以将腐植酸分为不同的类型,ΔlogK<0.6时,该类腐植酸被称为A型腐植酸;当0.6 <δlog> K<0.8时,为B型腐植酸;当0.8 <δlog> K<1.1时,被称为Rp型腐植酸;当光谱图在波长为615、570 、450 nm处有特征峰时,为P型腐植酸 [24]。因此表7中的3种腐植酸均为Rp型腐植酸。
2.3.2 红外光谱分析
为进一步了解腐植酸的结构和官能团排列,并对比生物腐植酸和化学腐植酸的芳香度及含氧结构参数,对3种腐植酸的FTIR分析如图3所示。
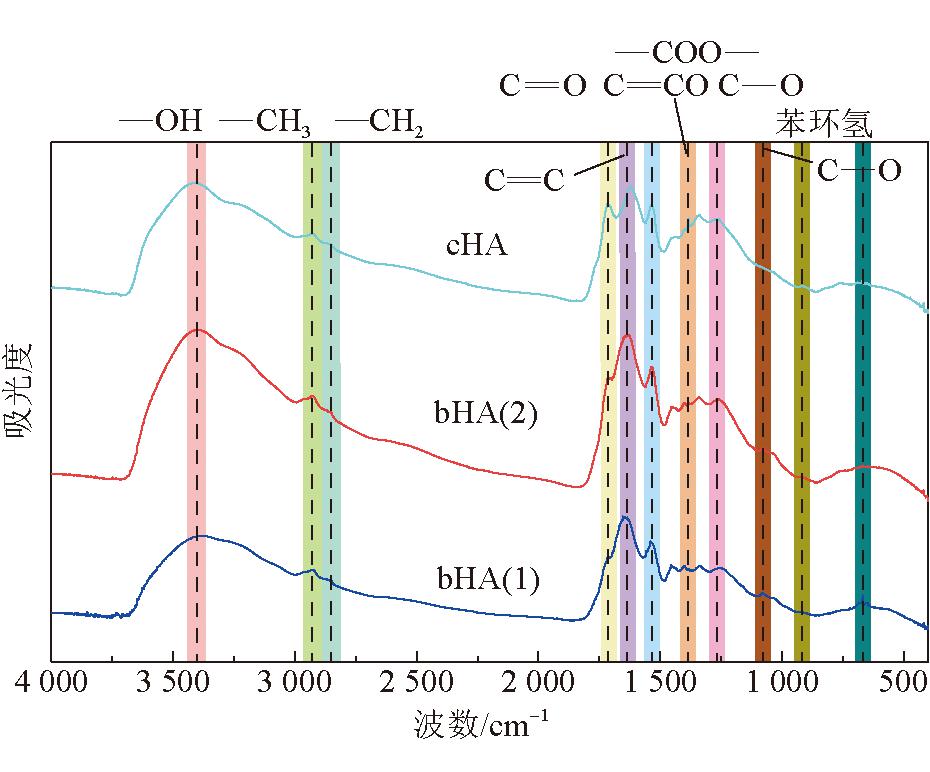
图3 3种腐植酸的FTIR分析
由图3可以看出,3种腐植酸样品的红外光谱特征峰及主要特征峰的出现位置基本相同。3 403 cm-1处的吸收峰是N-H或羟基(OH)伸缩振动的特征峰,位于2 928 cm-1和2 851 cm-1的2处吸收峰是脂肪族CH3和CH2的C-H伸缩振动的特征峰[25],将位于1 712 cm-1处的吸收峰归因于O=C的伸缩振动,位于1 634 cm-1的吸收峰是由于芳香族中C=C的伸缩振动与羰基共轭的C-C=O振动。图3中位于1 386 cm-1处的吸收峰是由于-COO-基的不对称拉伸和环状结构中的甲基和亚甲基以及叔丁基中的-CH键的变形震动引起的[23],2种生物腐植酸在该处的吸收峰明显弱于化学腐植酸。位于1 265 cm-1和1 122 cm-1的吸收峰是由酚羟基的OH变形和C-O拉伸振动引起的,同时吸收峰位于762 cm-1表示芳香族C-H的拉伸振动[26-27]。FTIR光谱的吸收峰主要分为4个区域:3 600~3 000 cm-1波段羟基(-OH)的吸收区,3 000~2 800 cm-1波段脂肪族结构的吸收区,1 800~1 000 cm-1波段含氧结构的吸收区,900~700 cm-1波段的芳环结构的吸收区[27],使用Origin Pro 2023绘图软件对这4个吸收峰分别进行拟合,得到高斯峰,并确定其面积、半峰宽等参数,从而确定DOC(缩合度)、C'(含氧结构参数)以及I(芳香度)[24]。腐植酸FTIR拟合结构参数见表8。3种腐植酸样品的红外分峰拟合图如图4~图6所示。
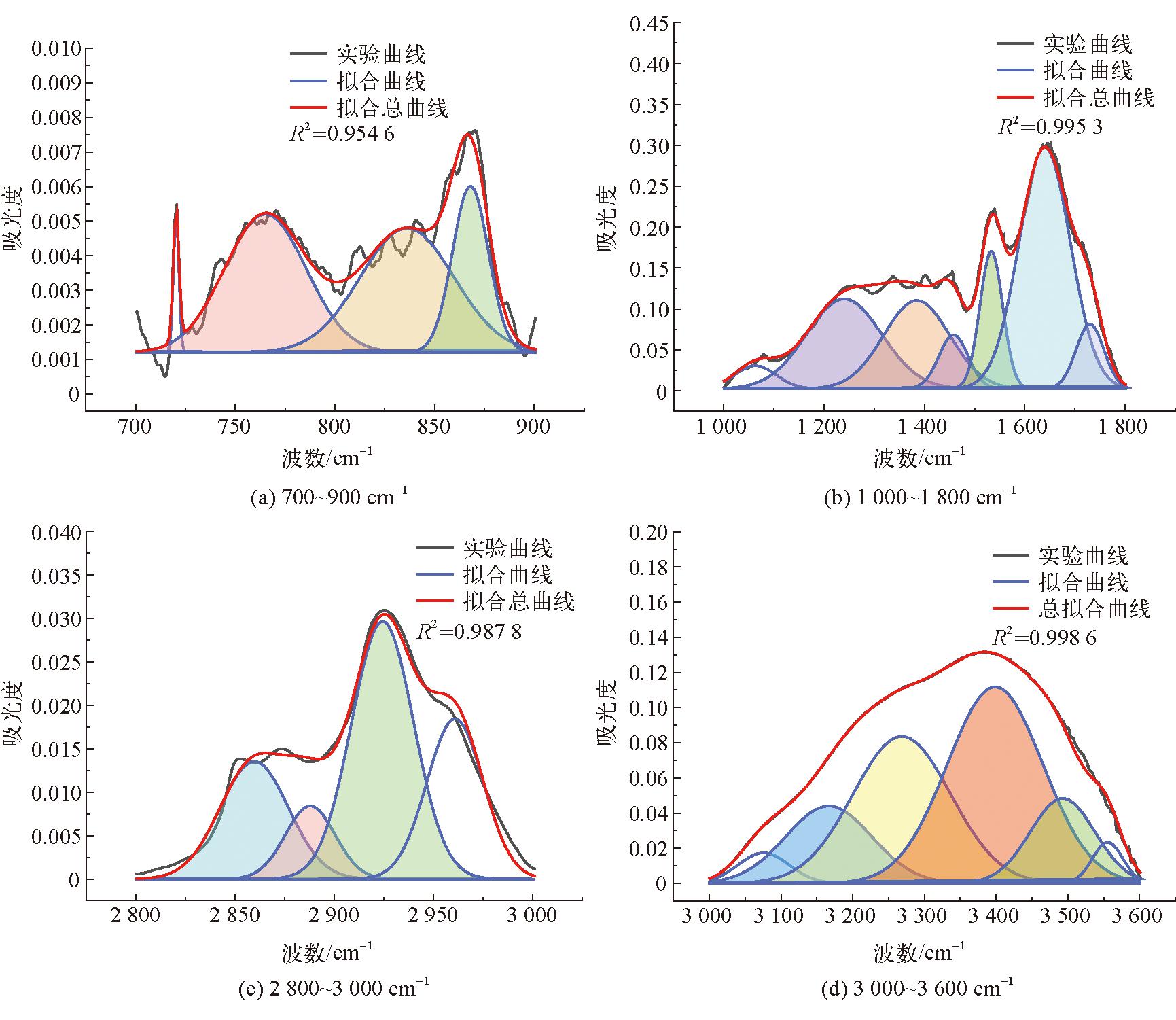
图4 bHA(1) FTIR分峰拟合
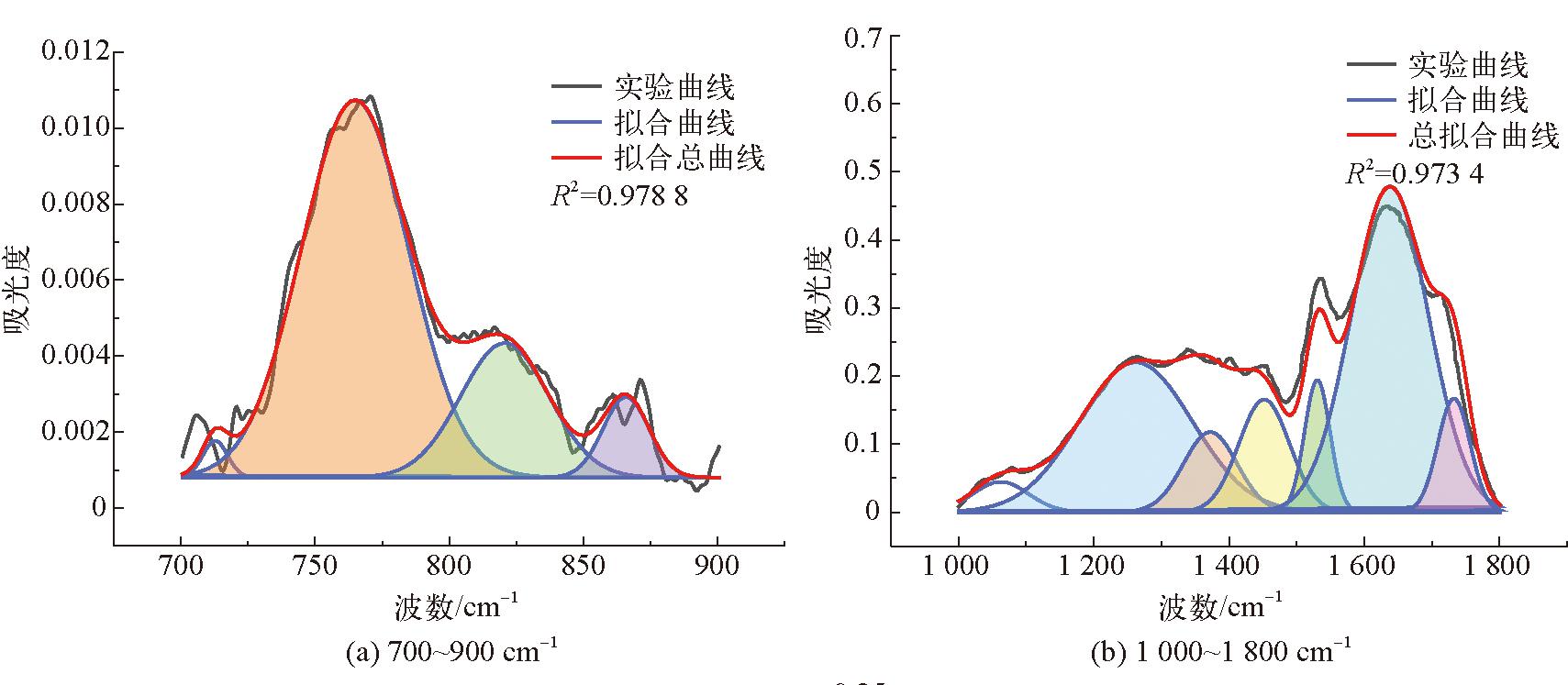
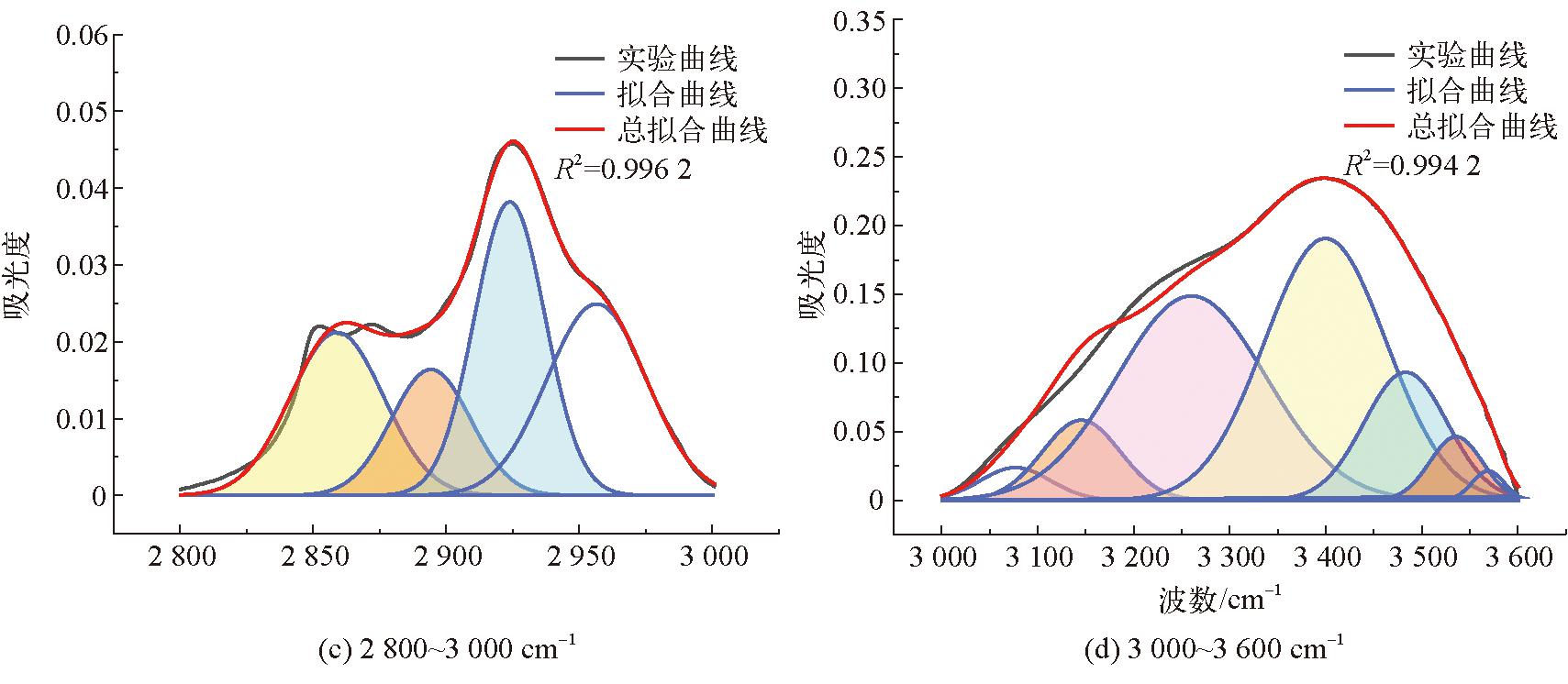
图5 bHA(2) FTIR分峰拟合
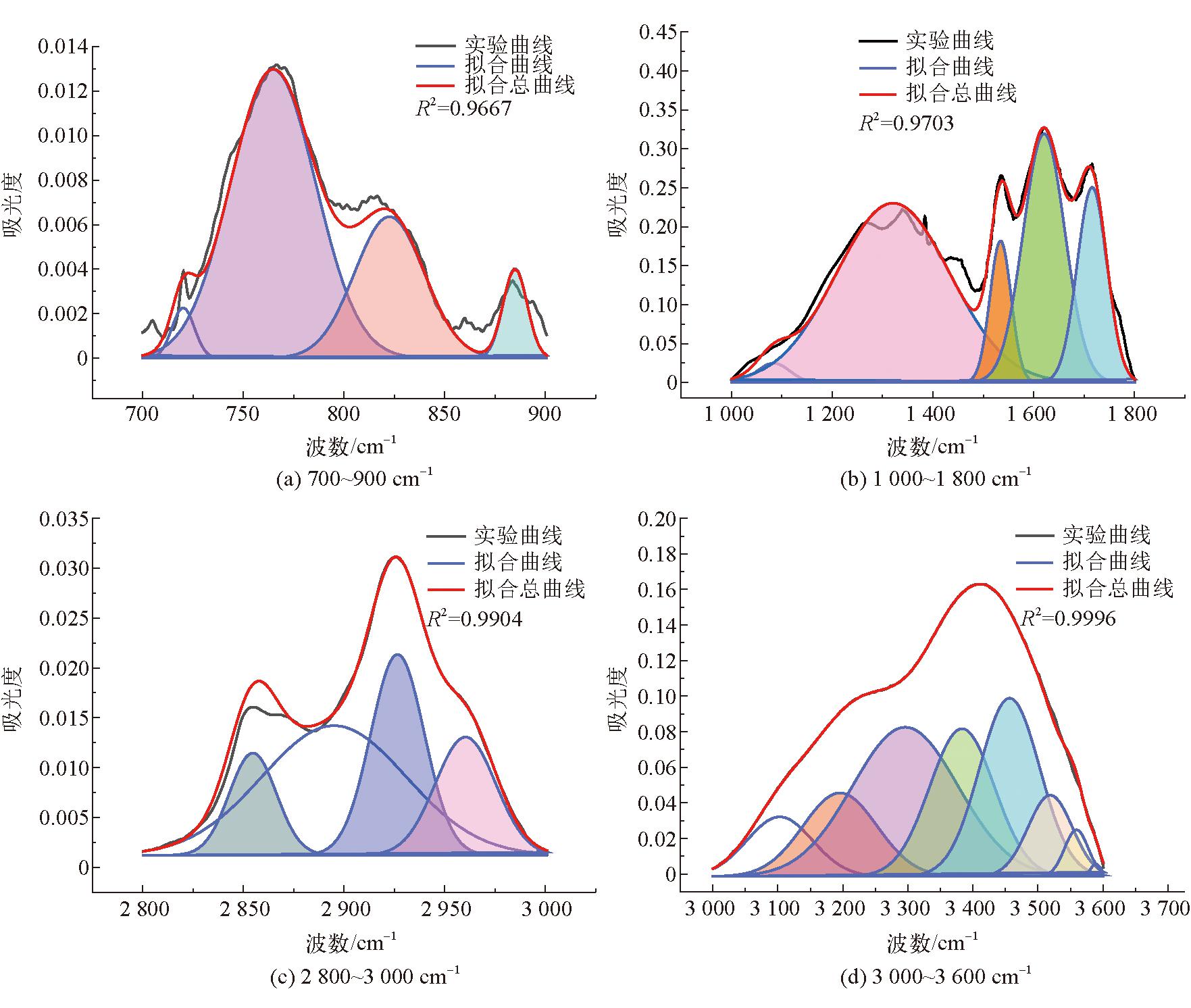
图6 cHA FTIR分峰拟合
表8 腐植酸FTIR拟合结构参数[28-29]
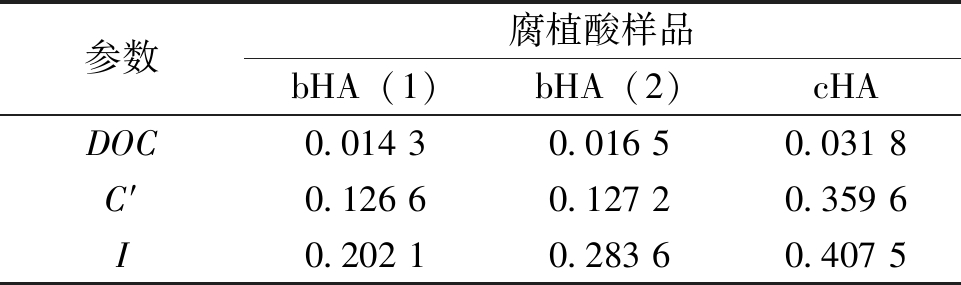
参数腐植酸样品bHA(1)bHA(2)cHADOC0.014 30.016 50.031 8C′0.126 60.127 20.359 6I0.202 10.283 60.407 5
由表8可以看出,2种生物腐植酸的DOC(缩合度)、C'(含氧结构参数)以及I(芳香度)总体上相差不大,但是粪产碱杆菌所提取的腐植酸的3种参数均略高于假单胞菌属提取的腐植酸,这说明假单胞菌属对蒙东褐煤中的芳烃结构的降解效果好于粪产碱杆菌[24-26],因此其提取的腐植酸结构会存在差异。
生物腐植酸与化学腐植酸相比,其缩合度、含氧结构参数以及芳香度均低于化学腐植酸,说明这生物腐植酸含有较多的脂肪族链以及低分子化合物;从C′可以看出,生物腐植酸的含氧官能团总数量小于化学腐植酸。
2.3.3 X- 射线光电子能谱分析
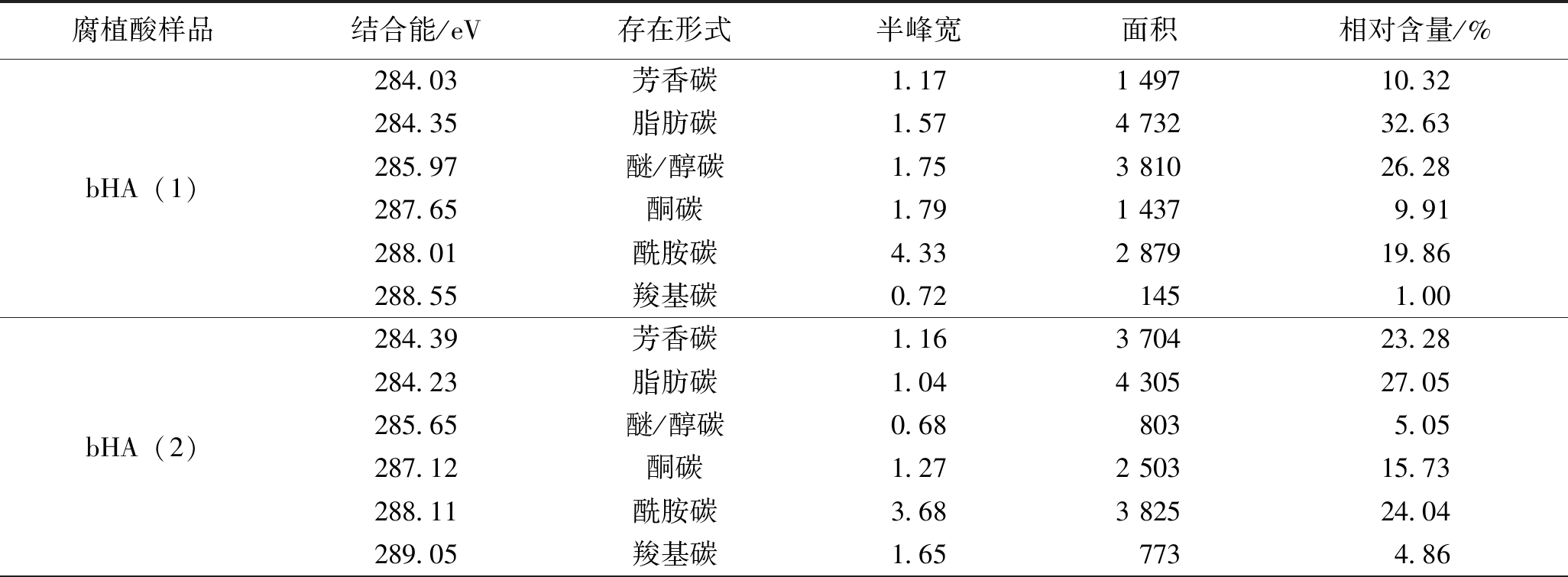
为了解这3种腐植酸样品的主要元素在其化学状态等方面的差异,通过XPS对3种腐植酸样品表面的主要元素进行分析。用XPS分析腐植酸的表面碳元素、氧元素以及氮元素,其中碳元素的化合态主要包括芳香碳、脂肪碳、醚/醇碳、酮碳、酰胺碳和羧基碳[30-31]。
对3种腐植酸的XPS的C1s谱图分峰拟合如图7所示。
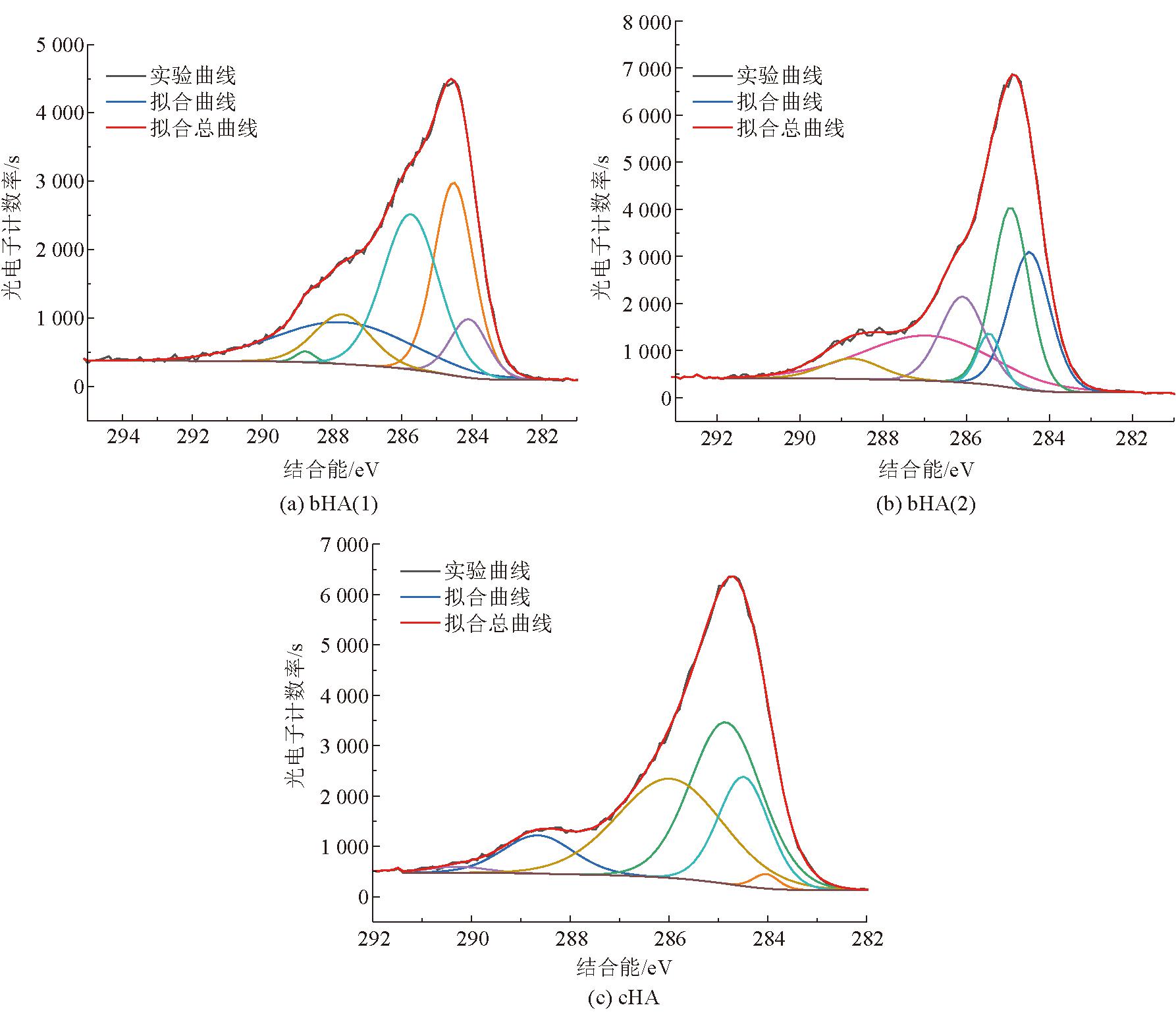
图7 3种腐植酸的XPS的C1s分峰拟合
由图7可以看出,3种腐植酸的C1s谱图可以拟合成6个峰,其所属的结合能分别是芳香碳(284.05±0.2 eV)、脂肪碳(284.55±0.2 eV)、醚/醇碳(286.05±0.2 eV)、酮碳(287.61±0.2 eV)、酰胺碳(288.01±0.2 eV)和羧基碳(288.65±0.2 eV),其各自结合能及分峰拟合数据见表9。
表9 3种腐植酸的XPS中C1s的存在形式及其含量
腐植酸样品结合能/eV存在形式半峰宽面积相对含量/%bHA(1)284.03芳香碳1.171 49710.32284.35脂肪碳1.574 73232.63285.97醚/醇碳1.753 81026.28287.65酮碳1.791 4379.91288.01酰胺碳4.332 87919.86288.55羧基碳0.721451.00bHA(2)284.39芳香碳1.163 70423.28284.23脂肪碳1.044 30527.05285.65醚/醇碳0.688035.05287.12酮碳1.272 50315.73288.11酰胺碳3.683 82524.04289.05羧基碳1.657734.86
续表9
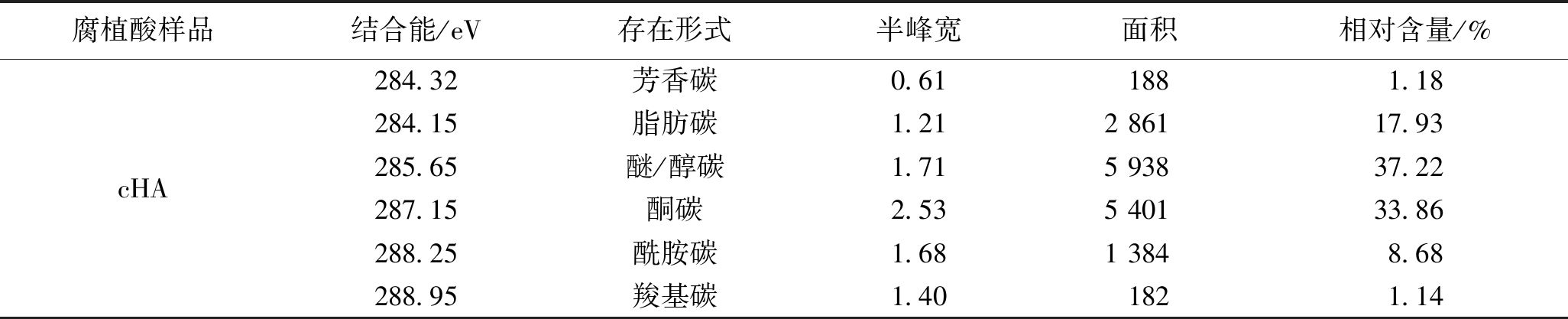
腐植酸样品结合能/eV存在形式半峰宽面积相对含量/%cHA284.32芳香碳0.611881.18284.15脂肪碳1.212 86117.93285.65醚/醇碳1.715 93837.22287.15酮碳2.535 40133.86288.25酰胺碳1.681 3848.68288.95羧基碳1.401821.14
由表9可以看出,生物腐植酸中碳元素的主要存在形式是芳香碳、脂肪碳、醚/醇碳以及酰胺碳,化学腐植酸中碳元素的主要存在形式是醚/醇碳和酮碳,而生物腐植酸中碳元素的主要存在形式也略有差异,这与上述腐植酸的红外光谱分析结果基本一致。
3种腐植酸的XPS的O1s分峰拟合如图8所示。
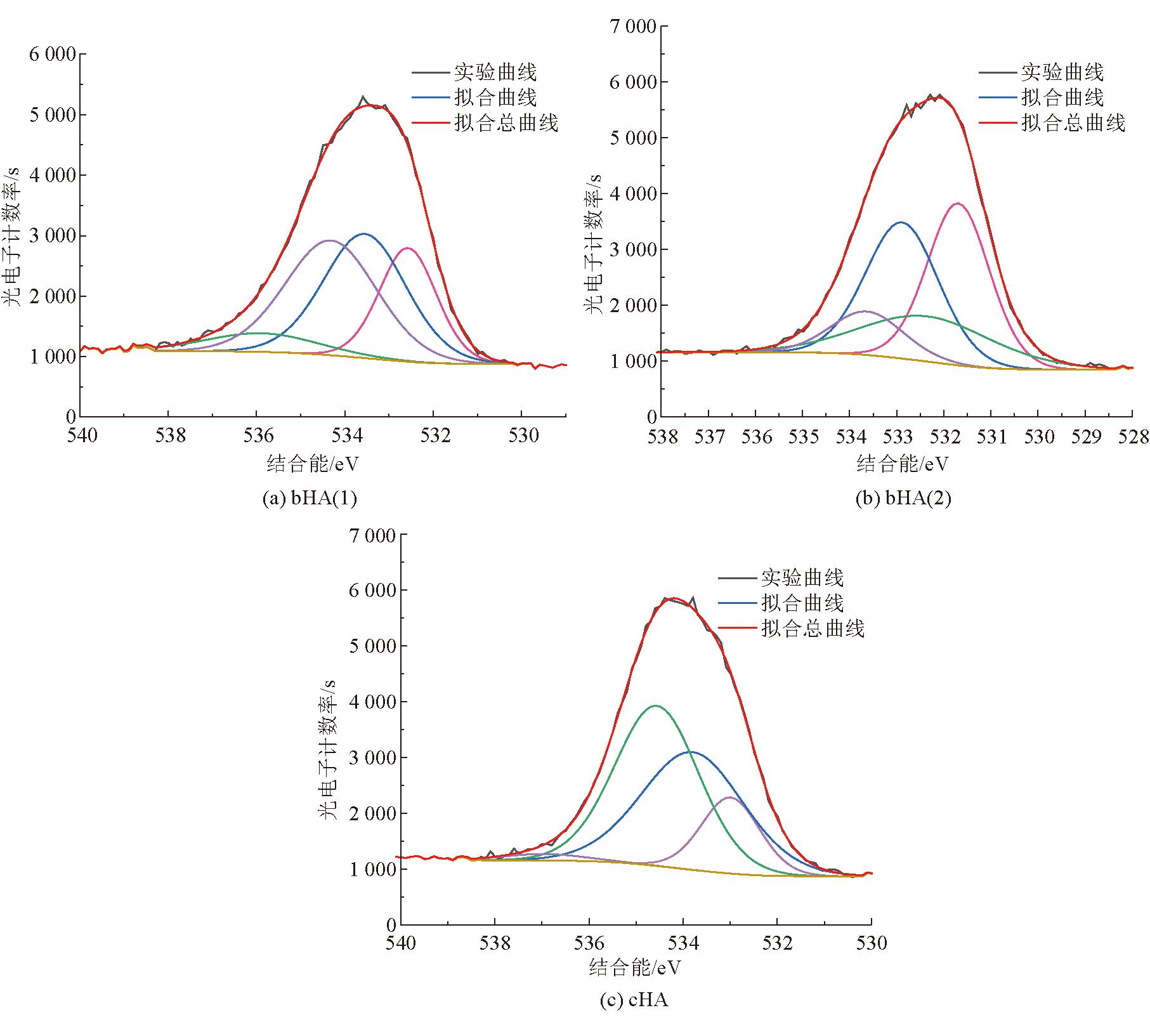
图8 3种腐植酸的XPS的O1s分峰拟合
由图8可以看出,3种腐植酸的O1s谱图可以拟合成4个峰,因此可将其化合态分为4种状态[32],其所属的结合能依次分别是羰基氧(532.61±0.2 eV)、醚/醇氧(533.51±0.2 eV)、羧基氧(534.61±0.2 eV)及吸附氧(535.96±0.2 eV),其各自结合能及分峰拟合数据见表10。
表10 3种腐植酸的XPS中的O1s的存在形式及其含量
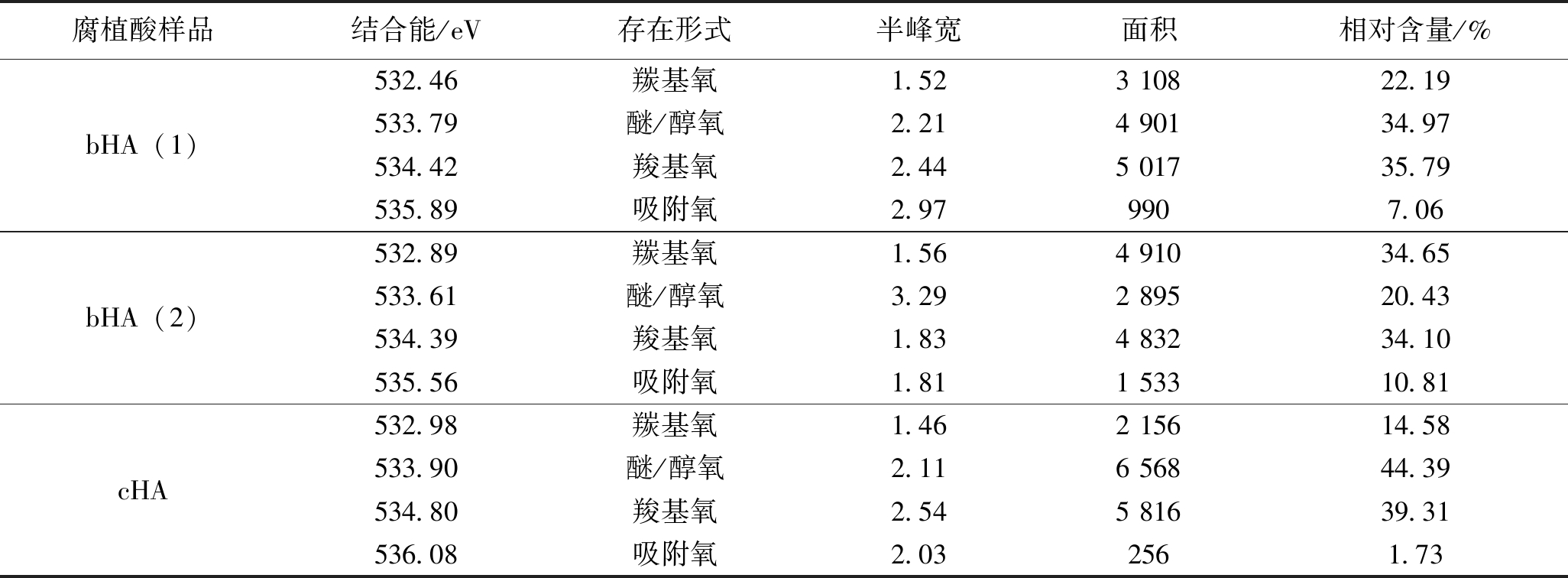
腐植酸样品结合能/eV存在形式半峰宽面积相对含量/%bHA(1)532.46羰基氧1.523 10822.19533.79醚/醇氧2.214 90134.97534.42羧基氧2.445 01735.79535.89吸附氧2.979907.06bHA(2)532.89羰基氧1.564 91034.65533.61醚/醇氧3.292 89520.43534.39羧基氧1.834 83234.10535.56吸附氧1.811 53310.81cHA532.98羰基氧1.462 15614.58533.90醚/醇氧2.116 56844.39534.80羧基氧2.545 81639.31536.08吸附氧2.032561.73
由表10可以看出,生物腐植酸中氧元素的主要存在形式为羰基氧、醚/醇氧、羧基氧,化学腐植酸中氧元素的主要存在形式为醚/醇氧、羧基氧,结合上述腐植酸的红外光谱分析结果可知,生物腐植酸中含氧官能团的总数量虽然略少于化学腐植酸,但是其含氧官能团种类数大于化学腐植酸。
3种腐植酸的XPS的N1s分峰拟合如图9所示。
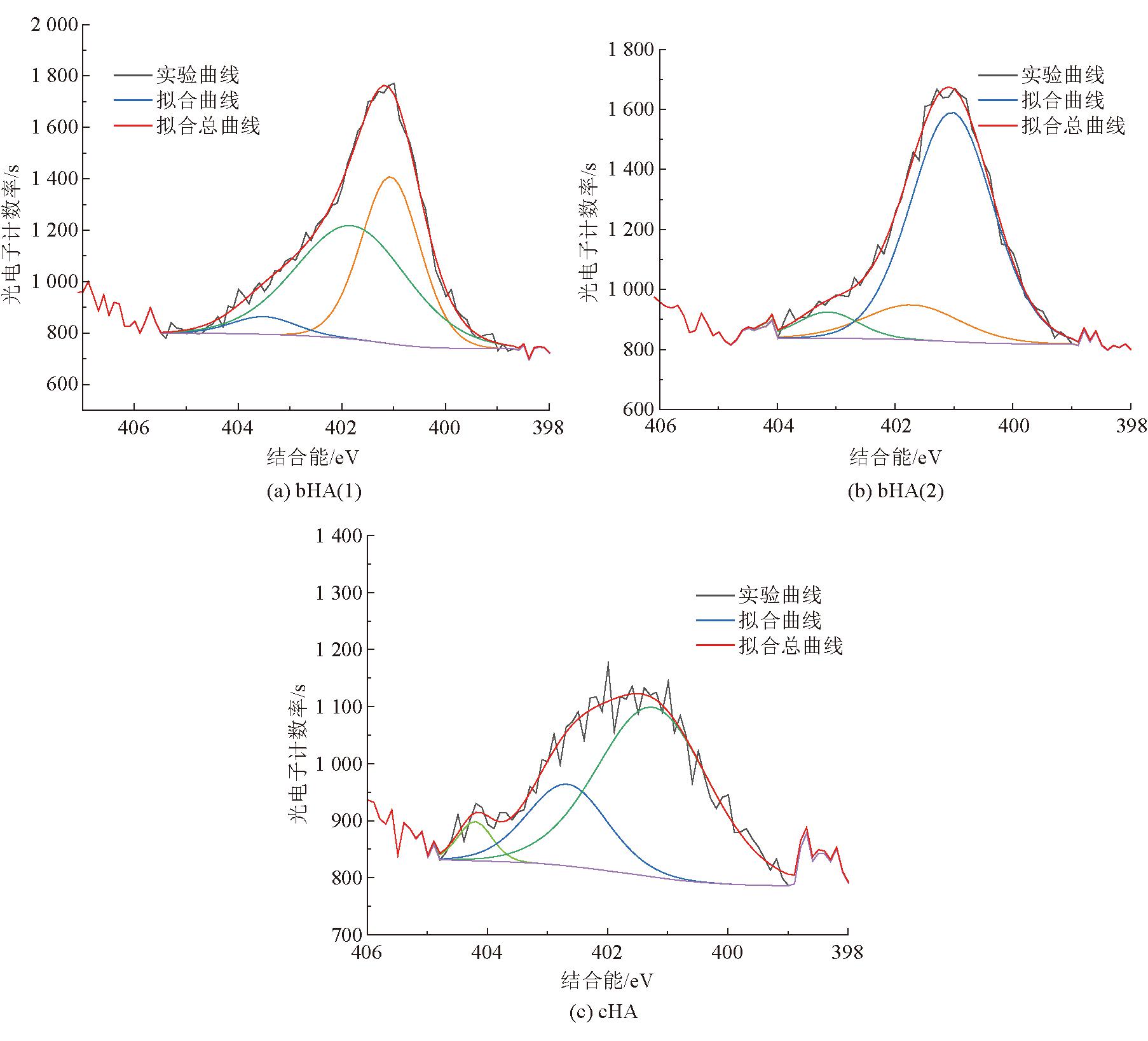
图9 3种腐植酸的XPS的N1s分峰拟合
由图9可以看出,3种腐植酸的N1s谱图可以拟合成3个峰,因此可将其化合态分为3种状态[27],其所属的结合能依次分别是芳香氮(401.01±0.4 eV)、杂环氮(402.01±0.4 eV)、伯胺氮(402.92±0.4 eV),其各自结合能及分峰拟合数据见表11。
表11 3种腐植酸的XPS中的N1s的存在形式及其含量
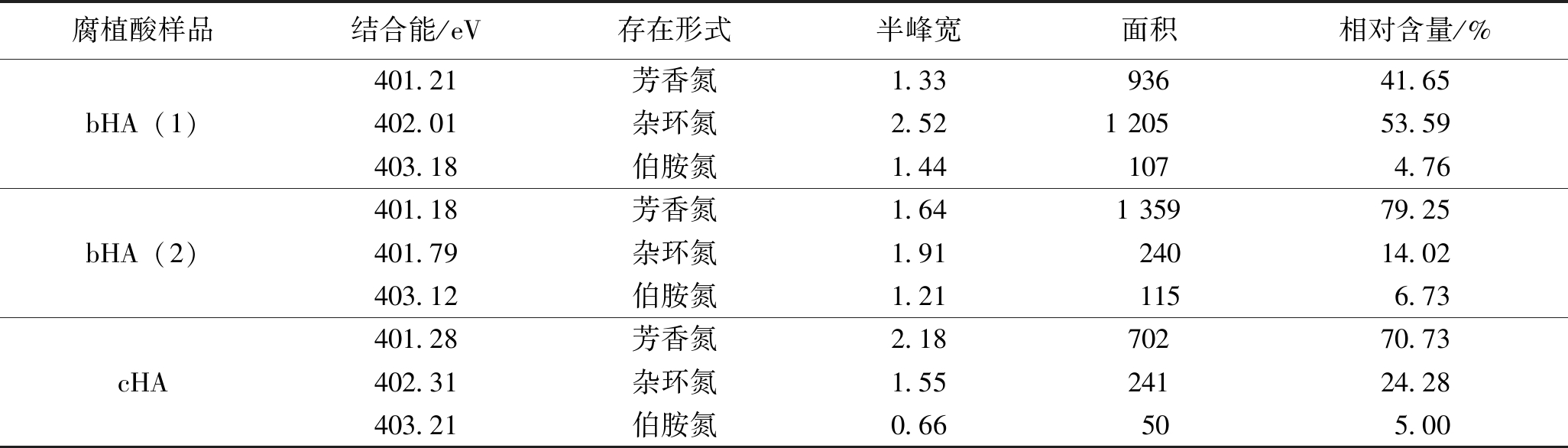
腐植酸样品结合能/eV存在形式半峰宽面积相对含量/%bHA(1)401.21芳香氮1.3393641.65402.01杂环氮2.521 20553.59403.18伯胺氮1.441074.76bHA(2)401.18芳香氮1.641 35979.25401.79杂环氮1.9124014.02403.12伯胺氮1.211156.73cHA401.28芳香氮2.1870270.73402.31杂环氮1.5524124.28403.21伯胺氮0.66505.00
由表11可以看出,化学腐植酸和生物腐植酸中氮元素的主要存在形式为芳香氮、杂环氮,由图9中3种腐植酸的峰高度可以看出,生物腐植酸的氮元素含量明显高于化学腐植酸。
2.3.4 腐植酸营养元素测定
本实验的3种腐植酸营养元素含量见表12。
表12 3种腐植酸营养元素含量 mg/kg

腐植酸样品NPKCaMgbHA(1)76.2891.05656.182 456.14347.64bHA(2)62.56108.55523.741 358.55130.10cHA32.0724.00225.46881.1187.02
由表12可以看出,生物腐植酸的N、P、K、Ca、Mg含量远大于化学腐植酸,其中N元素含量与上述XPS分析结果一致。N、P、K是作物生长所必须的营养元素,Ca、Mg为微量元素,但也是作物生长过程中所必不可少的元素[33-35]。同时这些营养元素也分为全量元素和有效态元素,有效态元素才是可以被植物所吸收的元素,腐植酸有助于提高营养元素的有效性,使其更容易被作物吸收[36-37]。生物腐植酸含有远高于化学腐植酸的营养元素,配合腐植酸提高营养元素的有效性,使得生物腐植酸比化学腐植酸作为农作物营养源更具优势。
3 结论
(1)通过单因素实验和正交实验得到了假单胞菌属在煤浆浓度0.5 g/50 mL、提取时间14 d、菌液用量2 mL/50 mL时对生物腐植酸的产率最高,最高产率为35.39%;粪产碱杆菌在煤浆浓度0.5 g/50 mL、提取时间12 d、菌液用量4 mL/50 mL时对生物腐植酸产率最高,最高产率为38.26%。
(2) UV-vis分析表明,2种生物腐植酸的分子量均小于化学腐植酸,且3种腐植酸均属于Rp型腐植酸;FTIR分析结果表明,假单胞菌属对蒙东褐煤中芳烃结构的降解效果好于粪产碱杆菌;由于生物腐植酸的缩合度、含氧结构参数以及芳香度均低于化学腐植酸,表明生物腐植酸含有较多的脂肪族链以及低分子化合物,且生物腐植酸含氧官能团的总数量要小于化学腐植酸。
(3)XPS的碳元素分析表明,生物腐植酸中碳元素的主要存在形式是芳香碳、脂肪碳、醚/醇碳以及酰胺碳,化学腐植酸中碳元素的主要存在形式是醚/醇碳和酮碳;氧元素分析表明,生物腐植酸中氧元素的主要存在形式为羰基氧、醚/醇氧、羧基氧,化学腐植酸中氧元素的主要存在形式为醚/醇氧、羧基氧。结合上述FTIR分析结果可知,生物腐植酸中含氧官能团的种类数大于化学腐植酸;氮元素分析表明化学腐植酸和生物腐植酸中氮元素的主要存在形式均为芳香氮、杂环氮,生物腐植酸的氮元素含量明显高于化学腐植酸。
(4)3种腐植酸的营养元素含量测定结果表明,生物腐植酸的N、P、K、Ca、Mg的含量远高于化学腐植酸,因此生物腐植酸作为农作物营养源时更具优势。
(5)综上所述,虽然利用细菌降解蒙东褐煤提取生物腐植酸的最高产率相对碱提取法降低了4.63%,且存在降解过程用时较长的问题,但是微生物降解法也具有清洁无污染、产品活性高等特点,而且生物腐植酸的营养元素远高于化学腐植酸,作为农作物营养源更具优势。
[1] 周道云. 内蒙古煤炭经济可持续发展的问题及对策研究[J]. 现代管理,2023,13(8):999-1004.
[2] 马秀欣,赵宏波. 我国泥炭,褐煤和风化煤的资源优势及其应用领域[J]. 中国煤炭,2004,30(9):47-49.
[3] 衡曦彤,程娟,何环,等. 微生物降解褐煤产腐植酸及应用研究进展[J]. 洁净煤技术,2019,25(6):88-95.
[4] 周静,刘向荣,赵顺省,等. 两种细菌降解新疆大南湖褐煤的最优工艺条件[J]. 煤炭降解,2021,44(5):10-22.
[5] 张传祥,张效铭,程敢. 褐煤腐植酸提取技术及应用研究进展[J]. 洁净煤技术,2018,24(5):6-12.
[6] CHENG G,NIU Z Y,ZHANG C X,et al. Extraction of Humic Acid from Lignite by KOH-Hydrothermal Method [J]. Applied Sciences,2019,9(7):2-13.
[7] ![]() L,Burdíková-Szewieczková J,Enev V,et al. Spectral characterization and comparison of humic acids isolated from some European lignites[J]. Fuel,2018,213(2):123-132.
L,Burdíková-Szewieczková J,Enev V,et al. Spectral characterization and comparison of humic acids isolated from some European lignites[J]. Fuel,2018,213(2):123-132.
[8] WANG M,LI Y,ZHANG Y,et al. Exploration of the H2O2 oxidation process and characteristic evaluation of humic acids from two typical lignites[J]. ACS omega,2021,6(37):24051-24061.
[9] FENG X,SUN J,XIE Y. Degradation of Shanxi lignite by Trichoderma citrinoviride[J]. Fuel,2021,291(5):120204.
[10] 尚煜超,刘向荣,石晨,等.郭家沟富油煤细菌降解产腐殖酸研究[J].中国煤炭,2023,49 (1):89-99.
[11] SHI C,LIU X,ZHAO S,et al. Sequential degradations of Dananhu lignites by Nocardia mangyaensis and Bacillus licheniformis[J]. Fuel,2022,318(6):123623.
[12] 王苗,李艳红,张远琴,等. 不同溶剂提取宝清褐煤腐植酸的工艺优化及其特性研究[J]. 煤炭降解,2021,44(2):51-61.
[13] 张田录,袁恺,戚继球.天宝红沙梁煤矿风化煤腐植酸提取工艺研究[J].中国煤炭,2023,49(4):57-63.
[14] LI H,DING S,YUAN J. Extraction of Humic Acids from Lignite and Its Use as a Biochar Activator[J]. ACS omega,2023,8(13):12206-12216.
[15] SHI C,LIU X,WU H,et al. Enhancements of mixed surfactants on Wucaiwan coal biodegradation by Nocardia mangyaensis[J]. Energy,2023,266(3):126501.
[16] YANG L,ZHANG Y,HAO Z,et al. Clean utilization of lignite to produce biomethane by optimizing the microbial community[J]. Energy,2023,262(1):125533.
[17] NIU Y,SUO Y,NIU X. Insights into the response mechanism of Fusarium sp. NF01 during lignite biodegradation using proteomic analysis[J]. Energy,2023,278(9):127990.
[18] SAVY D,DI Meo V,VERRILLO M,et al. Novel nanomaterials made of humic substances from green composts and chitosan exerting antibacterial activity[J]. ACS Sustainable Chemistry &Engineering,2023,11(26):9674-9683.
[19] XU Q,DUAN D,CAI Q,et al. Influence of humic acid on Pb uptake and accumulation in tea plants[J]. Journal of agricultural and food chemistry,2018,66(46):12327-12334.
[20] GUO H,HAN Q,ZHANG J,et al. Available methane from anthracite by combining coal seam microflora and H2O2 pretreatment[J]. International Journal of Energy Research,2021,45(2):1959-1970.
[21] 周宁一. 石油降解微生物[J]. 微生物学通报,2013,40(12):2335-2335.
[22] 吴昊,刘向荣,石晨,等. 基于日本假单胞菌超声破碎液对新疆乌东低阶煤降解过程的研究[J]. 煤炭学报,2022,47(8):3138-3147.
[23] M Giovanela,J S Crespo,M Antunes,et al. Chemical and spectroscopic characterization of humic acids extracted from the bottom sediments of a Brazilian subtropical microbasin[J]. Journal of Molecular Structure,2010,981(3):111-119.
[24] 王苗. 不同来源煤炭腐植酸的特性及其肥料应用研究[D]. 昆明:昆明理工大学,2023.
[25] 徐云龙,刘向荣,李建涛,等. 两种细菌降解内蒙古褐煤过程及液相产物分析[J]. 煤炭降解,2017,40(6):34-40.
[26] SHI C,LIU X,ZHAO S,et al. Additions of esterase and rhamnolipid promote the degradation of Inner Mongolia coal by Pseudomonas japonica[J]. Fuel,2023,340(1):127640.
[27] 赵星程,王博,冯炘,等. 褐煤生物甲烷产气量影响因素的初步探究[J]. 煤炭技术,2018,37(10):106-109.
[28] LU Q,WANG Z J,WANG J Y,et al. Deciphering the specific interaction of humic acid with divalent cations at the nanoscale[J]. Chemical Engineering Journal,2023,470(8):144097.
[29] 张远琴. 不同褐煤腐植酸的制备及其特性研究[D].昆明:昆明理工大学,2021.
[30] LI Z K,WEI X Y,YAN H L,et al. Insight into the structural features of Zhao tong lignite using multiple techniques[J]. Fuel,2015,153(8):176-182.
[31] LIU C,MA S,WANG X,et al. Biodegradation of organic compounds in the coal gangue by Bacillus sp. into humic acid[J]. Biodegradation,2023,34(2):125-138.
[32] ZHANG C,YAN A,GUO H,et al. DFT combined with XPS to investigate sulfur removal and sulfur-fixation mechanisms of copper oxide during coal pyrolysis and semi-coke combustion[J]. Fuel,2022,317(6):123482.
[33] 刘希瑶,刘澎,刘驰.典型黑土中有机质和养分元素的变化分析[J].地质与资源,2022,31(4):500-507.
[34] 姜冰,王松涛,孙增兵,等. 潍坊市土壤大量营养元素有效量及其影响因素[J]. 土壤,2023,55(1):218-223.
[35] De la Rosa José M,SantaOlalla Arturo,Campos Paloma,et al. Impact of biochar amendment on soil properties and organic matter composition in trace element-contaminated soil[J]. International Journal of Environmental Research and Public Health,2022,19(4):2140-2140.
[36] JING Y,ZHANG Y,HAN I,et al. Effects of different straw biochars on soil organic carbon,nitrogen,available phosphorus,and enzyme activity in paddy soil[J]. Scientific Reports,2020,10(1):8837-8837.
[37] UKALSKA-JARUGA A,BEJGER R,DEBAENE G,et al. Characterization of soil organic matter individual fractions (fulvic acids,humic acids,and humins) by spectroscopic and electrochemical techniques in agricultural soils[J]. Agronomy,2021,11(6):1067-1067.
Study on humic acid production from the degradation of Mengdong lignite by two kinds of bacteria

移动扫码阅读
- 相关推荐
